2025年12月2日,北京大学第三医院李默团队在《分子细胞》(Molecular Cell)在线发表题为“In vivo proteomic labeling reveals diverse proteomes for therapeutic targets”(体内蛋白质组标记技术揭示肿瘤治疗新靶点)的成果。

论文截图
该研究基于自主产生的APEX2-EGFPf/f小鼠和新型标记底物Btn-Ph-3F,首次成功研发普适化体内蛋白质组原位标记技术(IVPL, in vivo protein labeling),不仅实现了多器官、特定细胞群的高质量体内蛋白质组学描绘,也深度加强了“医化交叉”的思维范式并推动学科通融。
蛋白质组学作为生命科学与医学领域的核心技术之一,深化了我们对微观组学世界的认知。然而,当今绝大多数蛋白质组学研究仍然依赖“离体”样本。这种“从体外回推体内”的方式,成为后组学时代深入揭示疾病机制与实现精准治疗的巨大瓶颈。近年来,多位研究者发表APEX临近标记相关工作,并尝试利用AAV等手段在小鼠特定脑区表达标记酶,对神经元和星形胶质细胞进行蛋白质组研究。
然而,这些尝试仍然存在明显局限:缺乏专用、可广泛嫁接的基因工程小鼠模型,很难在全身多个器官、不同细胞群体中系统开展体内蛋白质标记;现有底物并非为复杂的哺乳动物体内环境“量身定制”,在血液循环、不同组织酶环境中稳定性和标记效率不足;对于诸如肿瘤外泌体等“外源蛋白”的体内命运,几乎完全依赖体外分离外泌体后的间接推断,难以真正回答:哪些外源蛋白最终在受体器官中“落地生根”,并驱动病理改变。
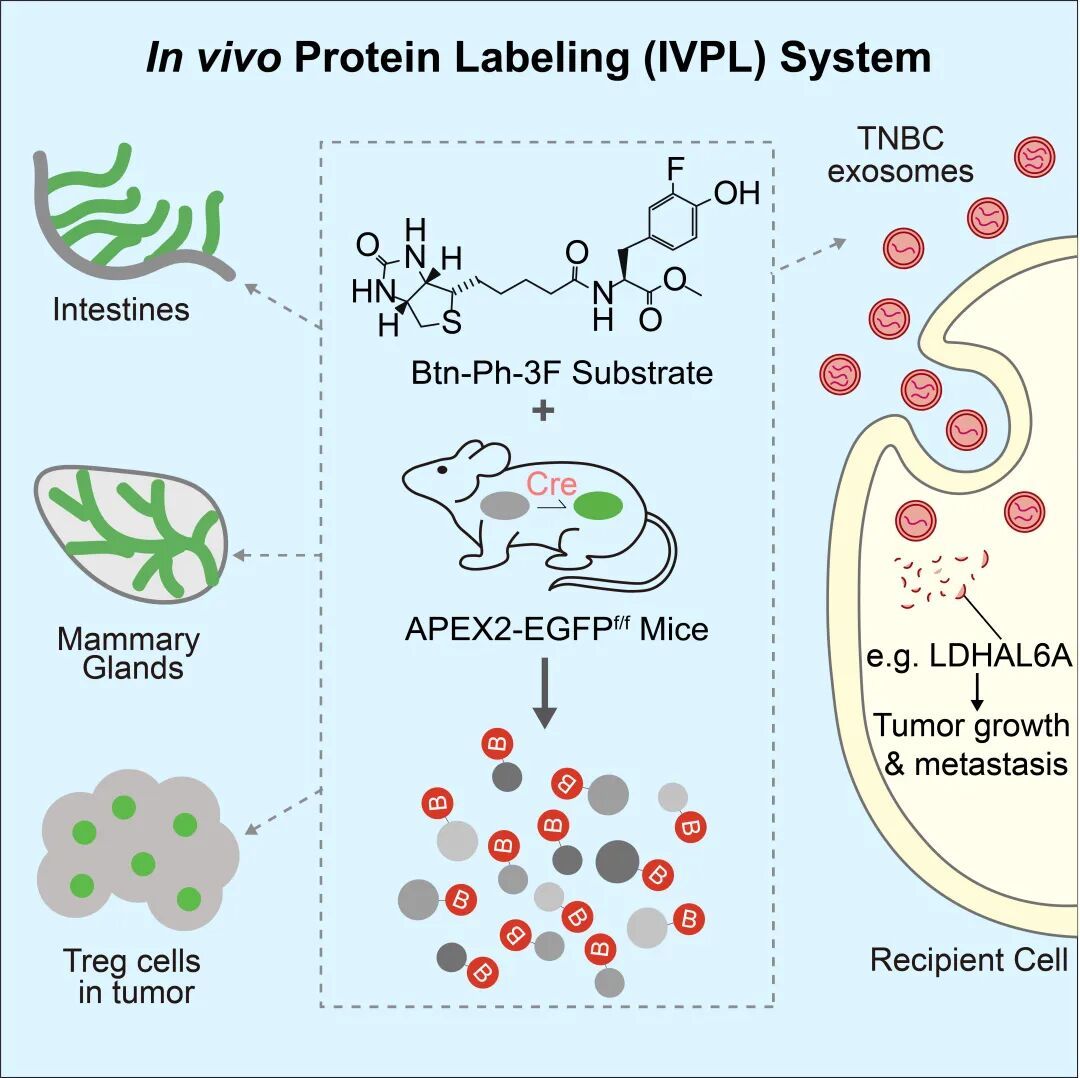
论文模式图
本研究中,团队构建的IVPL小鼠可与任意商业化Cre小鼠杂交,实现空间高度可定制的APEX2-EGFP表达。这一策略本质上将APEX2变成了一个“通用插槽”,为不同研究领域快速“接入”这一平台提供了高度可及性。与此同时,团队设计的新颖体内反应底物Btn-Ph-3F在肠道、乳腺等多种复杂组织中均具有良好的稳定性和反应性能。利用IVPL体系,研究者成功获取了肠上皮、乳腺上皮以及实体瘤中Treg细胞的高质量体内原位蛋白质组数据。
其后,团队将目光投向了一个长期困扰肿瘤研究领域的问题——外泌体在体内究竟如何重塑远端器官。过去二十年,大量关于肿瘤外泌体的蛋白质组学研究陆续发表,但几乎全部基于“体外分离外泌体→质谱鉴定”的经典流程。外泌体被受体细胞吞噬后,大部分会沿内吞–溶酶体途径被降解,只有极少数蛋白可以逃脱这一“命运”,并真正参与重塑受体细胞。传统策略很难鉴定这类痕量的、在体内真正发挥作用的外泌体蛋白质。
团队通过尾静脉注射分别给予Luminal-A型(LABC)和三阴型(TNBC)乳腺癌患者来源的外泌体,再在特定时间窗口以Btn-Ph-3F触发IVPL蛋白质标记,使得只有那些成功被乳腺细胞吞噬并未被降解的外源蛋白,在体内原位被生物素化并被质谱鉴定,并将这一集合命名为“uptake exo-proteome”,即本质上捕捉了“外泌体–受体器官轴线中真正落地的蛋白执行者”。
通过进一步分析,团队发现外泌体蛋白LDHAL6A实质性驱动TNBC的远端转移。敲低TNBC细胞中的LDHAL6A明显削弱了肿瘤细胞的增殖和侵袭能力;在PDX-及231-小鼠肿瘤模型中,靶向抑制LDHAL6A联合紫杉醇化疗可协同抑制肿瘤生长与肺转移,相比单药治疗具有更强的抗肿瘤效果。
IVPL技术有望在未来快速扩展到心脑血管疾病、自身免疫病、代谢性疾病以及组织再生与衰老等多个领域,推动研究走向“在体内、在原位、在真实微环境下理解蛋白质和疾病”的新阶段。
北京大学第三医院王琪龙、北京市朝阳医院姜月宁和北京大学第三医院毕美玉为该论文共同第一作者。北京大学第三医院李默教授为通讯作者。该研究受国家自然科学基金委交叉学部“杰出青年”基金、卓越研究群体、北京市自然科学基金重点项目等资助。
原文链接:https://doi.org/10.1016/j.molcel.2025.11.008